ANEXOS
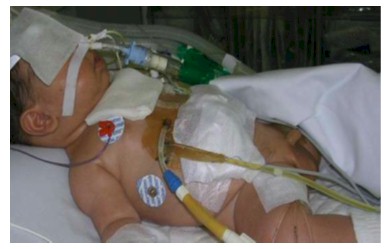
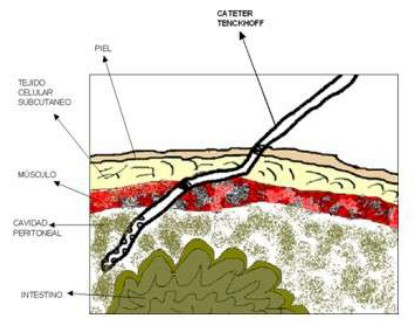
Anexo A. Punto de entrada del catéter
Autor Ramirez R, Padilla J. Disponible en:
http://ri.ues.edu.sv/151/1/10135964.pdf
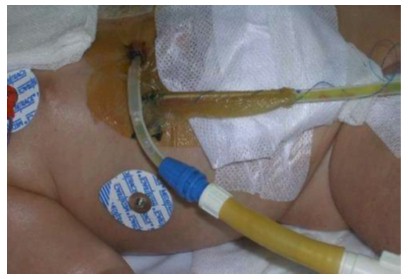
ANEXO B. Situación del catéter en abdomen
Autor Ramirez R, Padilla J. Disponible en:
http://ri.ues.edu.sv/151/1/10135964.pdf
Anexo C. Situación del catéter
Figura 8. Autor Ramirez R, Padilla J. Disponible en:
http://ri.ues.edu.sv/151/1/10135964.pdf
ANEXO D. ANÁLISIS DEL LÍQUIDO PERITONEAL
PROCEDIMIENTO
Se recibirán 2 tubos con 0.5-1.0 cc de muestra para estudio microbiológico y el otro para el citoquímico.
EXAMEN FÍSICO
Observar la muestra para anotar los siguientes aspectos:
Color:
Incoloro
Sanguinolento
Amarillo
Agua de coco
Café
Aspecto:
Limpio
Turbio
Leve turbio
Coagulación:
Negativo
Positivo a fibrina
Positivo a glóbulos rojos
Positivo a glóbulos blancos.
Sedimentos: (se observa después de centrifugado)
Negativo
Positivo a glóbulos rojos
Positivo a glóbulos blancos
Positivo a leve de glóbulos rojos
Positivo a leve de glóbulos de blancos
Positivo de glóbulos rojos y blancos
Positivo de bacterias
EXAMEN CITOLÓGICO
Recuento de glóbulos rojos y blancos: mezclar bien el tubo y con una pipeta Pasteur o micropipeta montar en la cámara de Neubauer y observar al microscopio al 10x y 40x, observar la ausencia o presencia de elementos.
Recuento directo:
Si se cuentan las 9 áreas primarias el número de glóbulos rojos se va a multiplicar por 10 entre 9 será igual Glóbulos x mm3
Si se cuentan las 4 áreas primarias será el número de glóbulos rojos por 10 mm3
Si se cuentan 2 áreas primarias opuestas número de glóbulos rojos por 50 será igual a glóbulos por mm3
Si se cuentan 5 áreas secundarias del área central el número de glóbulos por 500
Recuento con dilución
Si el líquido llega sanguinolento, purulento o no se puede realizar un recuento directo, hacer una dilución 1:5 ó 1:10 según amerite con solución salina 0.85% de la siguiente forma:
Dilución 1:5 = 100 ul liquido + 400 ul de solución salina.
Dilución 1:10= 100 ul liquido + 900 ul de solución salina.
Mezclar bien la dilución y montar en la cámara de Neubauer para hacer el recuento.
Cálculo:
Dilución 1:5
Si se cuenta un área primaria será el número de glóbulos por 50
Si se cuentan dos áreas primarias opuestas por 25
Dilución 1:10
Si se cuenta un área primaria será: el número de glóbulos por 100
Si se cuentan dos áreas primarias opuestas: número de glóbulos por 50
Si se cuentan cinco áreas secundarias del área central: número de glóbulos por
500
EXAMEN QUÍMICO
Poner a centrifugar el líquido a 3500 rpm por 5 minutos al sacar el tubo de la centrífuga observará la presencia o ausencia de sedimento.
Decantar el sobrenadante en un tubo o copa para analizar la glucosa y proteínas por el método que está realizando en ese momento en el laboratorio
Cuando el líquido tenga más de 10 leucocitos por mm3 hacer un recuento diferencial así:
1. Del sedimento hacer dos láminas, colocando dos gotas en cada una dejándola secar a temperatura ambiente.
2. No extender mucho la gota ya que cuando los elementos están escasos se dificulta hacer el recuento diferencial
3. Colocar una lámina con la coloración de Wright: colocar 3 gotas del colorante de Wright sobre el extendido del líquido e inmediatamente agregar 3 ó 4 gotas de buffer mezclar con perilla y dejar en reposo por 5 minutos, luego lavar con agua y secar a temperatura ambiente, observar a 100x para hacer el recuento diferencial y reportar el porcentaje de células.
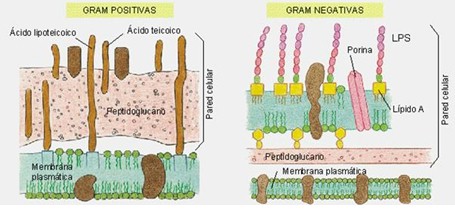
ANEXO E. COLORACIÓN DE GRAM
Debe su nombre al Bacteriólogo Danés Christian Gram que la desarrolló en 1844. Es una tinción diferencial, clasificando a las bacterias en Grampositivas y Gramnegativas, de acuerdo a las propiedades de su pared celular:
Autor Ramírez R, Padilla J. Disponible en:
http://ri.ues.edu.sv/151/1/10135964.pdf
Los pasos a seguir para realizar la tinción son los siguientes:
1º Fijamos la muestra mediante calor.
2º Violeta cristal (Tiñe todas las baterías, grampositivas y grfamnegativas) 1´.
3º Fijamos con Lugol, 1´.
4º Decoloremos con una mezcla alcohol-cetona (los gramnegativos se decoloren).
5º Safranina (colorante de contraste, tiñe a los gramnegativos), 1´.
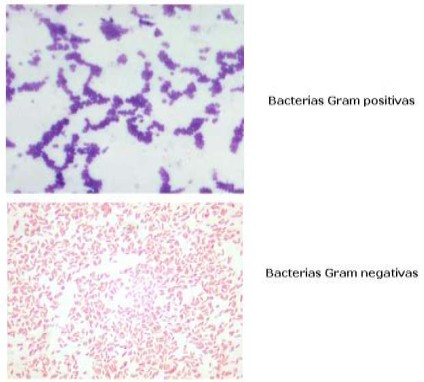
Los tiempos para aplicar cada colorante son orientativos. En la tinción se Observarán de color azul-violeta las grampositivas y de color rosa las gramnegativas.
Autor Ramírez R, Padilla J. Disponible en:
http://ri.ues.edu.sv/151/1/10135964.pdf
Los fundamentos de la técnica se basan en las diferencias entre las paredes celulares de las bacterias Gram positivas y Gram negativas. La pared celular de las bacterias Gram positivas posee una gruesa capa de peptidoglucano, además de dos clases de ácidos teicoicos: Anclado en la cara interna de la pared celular y unido a la membrana plasmática, se encuentra el ácido lipoteicoico, y más en la superficie, el ácido teicoico que está anclado solamente en el peptidoglucano (también conocido como mureína).
Por el contrario, la capa de peptidoglucano de las Gram negativas es delgada, y se encuentra unida a una segunda membrana plasmática exterior (de composición distinta a la interna) por medio de lipoproteínas. Tiene una capa delgada de peptidoglucano unida a una membrana exterior por lipoproteínas. La membrana exterior está hecha de proteína, fosfolípido y lipopolisacárido.
La diferencia que se observa en la resistencia a la decoloración, se debe a que la membrana externa de las Gram negativas es soluble en solventes orgánicos, como por ejemplo la mezcla de alcohol/acetona. La capa de peptidoglucano que posee es demasiado delgada como para poder retener el complejo de cristal violeta/yodo que se formó previamente, y por lo tanto este complejo se escapa, perdiéndose la coloración azul-violácea. Pero por el contrario, las Gram positivas, al poseer una pared celular más resistente y con mayor proporción de peptidoglicanos, no son susceptibles a la acción del solvente orgánico, sino que este actúa deshidratando los poros cerrándolos, lo que impide que pueda escaparse el complejo cristal violeta/yodo, y manteniendo la coloración azul-violácea.
ANEXO F. MEDIOS DE CULTIVO UTILIZADOS
AGAR CHOCOLATE
AGAR SANGRE
Medio para propósitos generales, para el aislamiento y cultivo de numerosos microorganismos.
Con la adición de sangre, el medio es útil tanto para el aislamiento y cultivo de microorganismos aerobios y anaerobios nutricionalmente exigentes a partir de una gran variedad de muestras, como para la observación de reacciones de hemólisis.
También, este medio de cultivo, puede utilizarse como medio base para preparar el medio agar chocolate.
Fundamento
La infusión de músculo de corazón y la peptona, otorgan al medio un alto valor nutritivo, que permite el crecimiento de una gran variedad de microorganismos, aún de aquellos nutricionalmente exigentes. El cloruro de sodio mantiene el balance osmótico.
El agregado de sangre al medio de cultivo, en concentración final de 5-10%, aporta nutrientes para el crecimiento bacteriano, y permite detectar hemólisis.
Fórmula (en gramos por litro)
Infusión de músculo de corazón – 375.0
Peptona – 10.0
Cloruro de sodio – 5.0
Agar – 15.0
pH final: 7.3 ± 0.2
Instrucciones
Suspender 40 g del polvo en un litro de agua destilada. Dejar reposar 5 minutos y mezclar perfectamente hasta obtener una suspensión homogénea. Calentar con agitación frecuente y hervir 1 minuto. Esterilizar 20 minutos a 121°C. Enfriar a 45-50°C agregar sangre desfibrinada al 5%. Homogeneizar y distribuir en placas.
Preparación de la placa de Agar Sangre: añadir en forma aséptica un 5% de sangre estéril desfibrinada a temperatura ambiente, el agar debe estar a 45°C.
Preparación de Agar Chocolate: después de añadir la sangre y agitando frecuentemente se mantiene el medio de cultivo a 80°C por 10 minutos hasta que adquiera un color pardo achocolatado.
Siembra
Por inoculación directa del material en estudio, sobre la superficie del medio de cultivo.
Incubación
El tiempo, temperatura y atmósfera de incubación, dependerán del microorganismo que se quiera aislar.
MacConkey
Este medio se utiliza para el aislamiento de bacilos Gram negativos de fácil desarrollo, aerobios y anaerobios facultativos. Permite diferenciar bacterias que utilizan o no, lactosa en muestras clínicas, de agua y alimentos. Todas las especies de la familia Enterobacteriaceae desarrollan en el mismo.
Fundamento
En el medio de cultivo, las peptonas, aportan los nutrientes necesarios para el desarrollo bacteriano, la lactosa es el hidrato de carbono fermentable, y la mezcla de sales biliares y el cristal violeta son los agentes selectivos que inhiben el desarrollo de gran parte de la flora Gram positiva.
Por fermentación de la lactosa, disminuye el pH alrededor de la colonia. Esto produce un viraje del color del indicador de pH (rojo neutro), la absorción en las colonias, y la precipitación de las sales biliares.
Los microorganismos no fermentadores de lactosa producen colonias incoloras.
Fórmula (en gramos por litro)
Peptona – 17.0
Pluripeptona – 3.0
Lactosa – 10.0
Mezcla de sales biliares – 1.5
Cloruro de sodio – 5.0
Agar – 13.5
Rojo neutro – 0.03
Cristal violeta – 0.001
pH final: 7.1 ± 0.2
Instrucciones
Suspender 50 gramos del polvo por litro de agua destilada. Reposar 5 minutos y mezclar hasta uniformar. Calentar suavemente y hervir 1 a 2 minutos hasta disolver. Esterilizar en autoclave a 121°C durante 15 minutos.
Siembra
– Sembrar en superficie.
– Utilizando la técnica de Pour Plate: sembrar 1 ml de muestra y agregar aproximadamente 15 ml de medio de cultivo fundido y enfriado a 45-50 ºC.
Incubación
Durante 18-48 horas, a 35-37 ºC, en atmósfera aeróbic
HEMOCULTIVO