El suero antiofídico se administró a todos los casos, incluyendo los clasificados en grado 0, lo que no recomiendan algunos autores, que esperan la aparición de signos sistémicos o la progresión de los signos locales para administrar el antiveneno.
A los siete casos de la escala 0, se les realizó cura local (8,1% de los pacientes), para un riesgo relativo de RR: RR 0,09 (IC 95%: -0,09-0,26), p < 0.001.
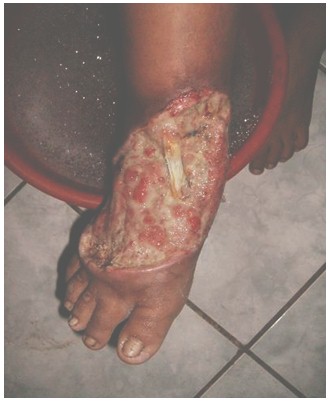
El Desbridamiento (Ver Fotografía 5), se realizó en 72,4% de los casos, desde el grado 1 al grado IV, para un riesgo relativo de realizar este procedimiento de RR 2,63 (IC 95%: 2,29-2,96), p < 0.001.
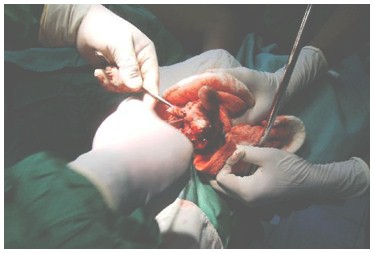
Se realizaron 10,4% de Fasciotomías (Ver Fotografía 6), casi todos grado 2 y 3, para un riesgo relativo de realizar este procedimiento de RR 0,12 (IC 95%:- 0,07-0,30), p < 0.00.
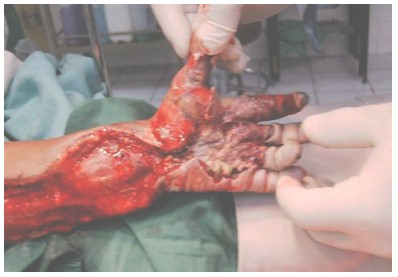
Las amputaciones (Ver Fotografía 7) se realizaron en 9,2% de los casos RR 0,10 (IC 95%: -0,08-0,28), p < 0.001.
Discusión
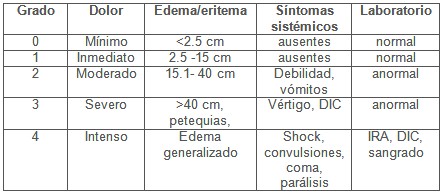
Existen diferentes escalas de lesiones para evaluar las mordeduras de serpientes, en este reporte hemos usado la que aparece en el cuadro 3 (5).
Cuadro 3. Escala de lesiones
En Guatemala se ha demostrado efectividad del suero antibothrops producido en otros países de Centroamérica contra la mordida de la variedad de Bothrops que existe en Guatemala (6), lo que refleja una alta reactividad cruzada de los antiveneno botrópicos en la región (7). En América Central y en México se producen antivenenos polivalentes botrópico-crotálico y, en Costa Rica, botrópico-crotálico-laquésico (8)
La potencia del veneno medida por la dosis letal media (LD50) en ratones difiere marcadamente entre las especies y más aún entre las familias. Existe una variedad, la Bothrops Atrox, cuya dosis letal de veneno es 62 mg (9), capaz de inocular hasta 342 mg en una mordida, aunque nosotros no la encontramos en Guatemala, si se distribuye en América del sur: Venezuela, Colombia, Perú, Ecuador, Brasil, Bolivia y selva amazónica.
En el veneno de la Bothrops Asper se ha aislado una fosfolipasa miotóxica homóloga a la fosfolipasa A2, que produce obstrucción de los vasos linfáticos, responsable del gran edema observado (10).
Las víctimas de los accidentes deben permanecer quietas, sin actividad muscular y sin elevar el miembro, o más bien manteniéndolo por debajo del nivel del corazón para demorar la diseminación del veneno.
Los intentos de resecar o succionar la herida, de colocar hielo o torniquetes, no se recomiendan, sobre todo si son realizados por personal no calificado. En situaciones extremas, de inaccesibilidad a los servicios médicos, se ha intentado la aspiración local inmediata de la mordedura, con aditamentos que crean vacío, pero la succión pasados 3 minutos elimina menos de una milésima del veneno inyectado (11).
El tratamiento más efectivo es el suero antiveneno específico, si se le administra antes de 10 horas después de la mordida, la incidencia de complicaciones disminuye (12), pero ha funcionado incluso hasta 24 horas después.
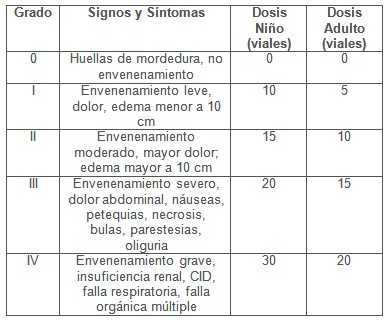
Se ha utilizado la escala de Christopher y Redding (3) de 1986, para calcular la dosis de antiveneno, que para la lesión grado 0 no lo indica (Cuadro 4), esto es peligroso, algunas mordidas que parecen localmente insignificantes, pueden progresar hacia lesiones más severas en horas y aún ser letales, por eso aplicamos el antiveneno en todos los casos, a esto le achacamos la baja mortalidad -2,3%-.
También usamos sistemáticamente profilaxis antitetánica y antibióticos de amplio espectro, en general, cefalosporinas de 3ra generación.
El uso actual de antivenenos polivalentes purificados obtenidos de ovejas inmunizadas ha mejorado la respuesta, la dosis de carga es de 4-6 viales de antiveneno (cada ml neutraliza 2 mg de veneno), diluido en 250 ml de solución salina, en infusión lenta durante 10 minutos (20-50 ml/hora) y si no se producen reacciones anafilácticas graves, se termina de administrar en 1 hora. Si se logra el control, se administran dosis de mantenimiento: dos nuevos viales a las 6, 12 y 18 horas siguientes.
Hasta 25% de las mordidas de serpientes venenosas pueden estar desprovistas de veneno (13).
Cada 15 -30 minutos se mide el progreso del edema perilesional y el avance del borde, si es en una extremidad se mide la circunferencia en 3 puntos proximales a la mordida, si el edema, la necrosis y las flictenas siguen progresando, se repite la dosis de ataque. La tendencia de las pruebas de coagulación a normalizarse es otra evidencia de la eficacia del antiveneno (14).
Escala de Christopher y Rodning (3)
Cuadro 4. Escala de lesiones y dosis en viales de suero antiveneno.
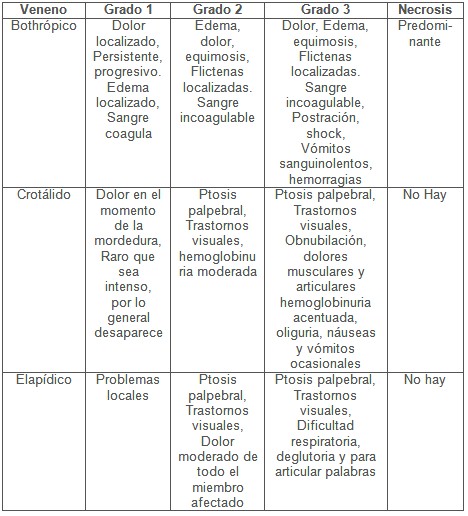
La administración de los sueros antiofídicos no está exenta de reacciones adversas, al punto de que algunos autores recomiendan una prueba previa de sensibilidad al antídoto, y si es positiva premedicar al paciente con adrenalina y antihistamínicos antes de administrar el antiveneno (15). Para elegir el antídoto especifico, se ha tratado de describir un cuadro clínico diferenciado (Cuadro 5) para cada tipo de serpiente venenosa (16).
Cuadro 5: Cuadro Clínico relacionado con el tipo de serpiente venenosa.
Otros investigadores no han encontrado diferencias en el cuadro clínico, aun cuando los inmuno análisis enzimáticos sean capaces de detectar las diferentes especies (17).
Últimamente han aparecido reportes en la literatura que modifican la dosis de antiveneno a administrar, planteando una sola dosis independientemente del grado de lesión (18), o tres, seis, o nueve viales, en relación al grado de envenenamiento: ligero, moderado, severo (19).
Conclusiones.
Predominaron los sujetos masculinos, menores de 30 años, con mordeduras en Miembros inferiores y lesiones tipo II.
Observamos efectos locales severos en 91,9% de los pacientes, en estos fue necesario algún tipo de tratamiento quirúrgico: desbridamiento (72,4%), fasciotomías (10,4%), o amputaciones (9,2%).
Se evidenciaron efectos sistémicos: trastornos de la coagulación (81,6%), shock (3,4 %), Insuficiencia Renal (8,0%) y muerte en 2,3% de los pacientes.
El tratamiento con antiveneno especifico, administrado lo antes posible, y repetido las veces necesarias, controló 97,7 % de los casos.
Recomendaciones.
Prevención de los accidentes ofídicos agrícolas con el uso de botas y guantes de labranza.
Disponer de anti-venenos polivalentes en los centros asistenciales de las comunidades rurales para su uso inmediato.
Anexos.
Fotografía 1: serpientes de Guatemala (20).
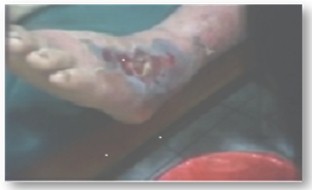
Fotografía 2. Mordedura grado 1. Pie derecho, se observa edema y necrosis
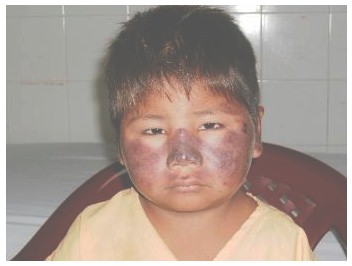
Fotografía 3: mordedura grado 2 en el rostro. Marca de colmillos visible.
Fotografía 4. Mordedura grado 3. Edema de todo el miembro superior. Aéreas de Necrosis en la mano. Flictenas se extienden hasta el brazo.
Fotografía 5: Mordedura grado 2. Pie derecho, post-desbridamiento
Fotografía 6: Fasciotomía por Síndrome compartimental, mordedura grado 3.
Fotografía 7: amputación de todos los dedos de la mano, solo se conserva el pulgar
Bibliografía
1) GUTIÉRREZ, José María. Envenenamientos por mordeduras de serpientes en América Latina y el Caribe: Una visión integral de carácter regional. Bol Mal Salud Amb. [online]. jun. 2011, vol.51, no.1 [citado 03 Junio 2012], p.1-16. Disponible en la World Wide Web: . ISSN 1690-4648.
2) Gutiérrez J. M., Higashi H. G., Wen F. H. & Burnouf T. Strengthening antivenom production in Central and South American public laboratories: report of a workshop. Toxicon. 2007; 49: 30-35.
3) Jorge Tay Zavala, 1 Joel Gerardo Díaz Sánchez, 1 José Trinidad Sánchez Vega,1 Dora Ruiz Sánchez,1 Luis Castillo. “Serpientes y reptiles de importancia médica en México”. Rev. Fac Med UNAM 2002, 45 (5): 212-219.
4) Gold BS, Dart RC, Barish RA: Bites of venomous snakes. N Engl J Med. 2002; 347(5):347-356.
5) Gregory J. Jurkovich; Larry M. Gentilello. “Envenomation and Environmental Injuries. ENVENOMATION. Snakes and Snakebites” Chapter 33, page. In Greenfield’s Surgery: Scientific Principles and Practice, Editors: Mulholland, Michael W.; Lillemoe, Keith D.; Doherty, Gerard M.; Maier, Ronald V.; Upchurch, Gilbert R. 4th Edition, Copyright ©2006 Lippincott Williams & Wilkins
6) Saravia P., Rojas E., Escalante T., Arce V., Chaves E., Velásquez R. The venom of Bothrops asper from Guatemala: toxic activities and neutralization by antivenoms. Toxicon. 2001; 39: 401-405.
7) Segura A., Castillo M. C., Núñez V., Yarlequé A., Gonçalves L. R. C., Villalta M. Preclinical assessment of the neutralizing capacity of antivenoms produced in six Latin American countries against medically-relevant Bothrops snake venoms. Toxicon. 2010, 56: 980-989.
8) Calvete J. J. Antivenomics and venom phenotyping: A marriage of convenience to address the performance and range of clinical use of antivenoms. Toxicon. 2010; 56: 1284-1291.
9) Gutiérrez J. M. (2009). Snakebite envenomation in Central America. pp. 491-507. En: Handbook of venoms and toxins of reptiles. Ed. Mackessy S.P. CRC Press, Boca Raton, USA.)
10) Mora J, Mora R, Lomonte B, Gutiérrez JM. “Effects of Bothrops asper snake venom on lymphatic vessels: insights into a hidden aspect of envenomation”. PLoS Negl Trop Dis. 2008;2(10):e318. Epub 2008 Oct 15.
11) Alberts M, Shalit M, LoGalbo F (). «Suction for venomous snakebite: a study of «mock venom» extraction in a human model». Ann Emerg Med 2004; 43 (2): 181–6. doi:10.1016/S0196-0644(03)00813-8. PMID 14747805
12) Boels D, Hamel JF, Bretaudeau Deguigne M, Harry P. European viper envenomings: Assessment of Viperfav™ and other symptomatic treatments. Clin Toxicol (Phila). 2012 Mar; 50(3):189-96.
13) Manual Merck, undécima edición, 2007, Elsevier España, S.A.
14) Rodríguez-Acosta A, Aguilar I, Girón ME. Biochemical and hematological effects of Uracoan rattlesnake (Crotalus vegrandis) venom on hamster (Cricetus auratus). J Nat Toxins 1996; 5: 401-407.
15) Habib AG. “Effect of pre-medication on early adverse reactions following antivenom use in snakebite: a systematic review and meta-analysis”. Drug Saf. 2011 Oct 1; 34(10):869-80. doi: 10.2165/11592050-000000000-00000.
16) Sandoval Cálix, W. “Caso dramático por Mordedura de barba amarilla”. Revista médica hondur. 1985; 53: 304-306.
17) Pardal PP, Souza SM, Monteiro MR, Fan HW, Cardoso JL, França FO, Tomy SC, Sano-Martins IS, de Sousa-e-Silva MC, Colombini M, Kodera NF, Moura-da-Silva AM, Cardoso DF, Velarde DT, Kamiguti AS, Theakston RD, Warrell DA. Clinical trial of two antivenoms for the treatment of Bothrops and Lachesis bites in the north eastern Amazon region of Brazil. Trans R Soc Trop Med Hyg. 2004 Jan; 98(1):28-42.
18) Boels D, Hamel JF, Bretaudeau Deguigne M, Harry P. European viper envenoming: Assessment of Viper other symptomatic treatment. Clin Toxicol (Phila). 2012 Mar; 50(3):189-96.
19) Otero R, Gutiérrez JM, Núñez V, Robles A, Estrada R, Segura E, Toro MF, García ME, Díaz A, Ramírez EC, Gómez G, Castañeda J, Moreno MEA randomized double-blind clinical trial of two antivenoms in patients bittenn by Bothrops atrox in Colombia. Trans R Soc Trop Med Hyg. 1996 Nov-Dec; 90(6):696-700.
20) Sandoval, Priscila. Serpientes de Guatemala: Zoología e Iconografía, Asociación FLAAR, Mesoamérica, octubre 2009.